中国网/中国发展门户网讯近年来随着生命科学和生物技术的进步,生物制药行业快速的提升,已成为全世界经济核心产业之一。该行业近10年的年复合增长率约10%,2023年的市场规模已超过4 000亿美元,各国政府均给予生物制药极大的重视。例如,欧盟委员会于2024年制定《与自然共建未来:推动生物技术和生物制造》文件,韩国、美国、日本、印度和欧盟在2024年生物国际大会上发起生物制药联盟,我国的《“十四五”生物经济发展规划》中将“发展面向人民生命健康的生物医药”作为生物经济四大重点领域之一。
作为战略性新兴起的产业之一,生物制药行业的发展离不开核心技术的变革创新。微球作为重要的功能材料,以其灵活多变的粒径、形貌、结构、功能,在生物药物的发现、制备、纯化、递送等多个环节均发挥重要作用。
微球一般指粒径在纳米至微米级别的纳微材料,其形状多为球形,表面形貌和内部结构可根据用途不同进行调控,常见的表面形貌及内部结构包括多孔、刺突、实心、空心等。在生物制药的发展史上,微球多次作为核心关键材料,促进了生物制药技术的变革和创新。例如,细胞培养方面,以微球为基础的微载体出现,推动了动物细胞培养技术从作坊式的转瓶培养变革为用微载体的工业化生物反应器,极大地提高了生产效率、产量和质量,节约了人力成本。生物大分子分离纯化方面,由于生物大分子结构复杂,易发生变构失活,传统的化工技术(萃取、精馏、膜分离等)难以对其实现有效分离,交联琼脂糖微球等介质结合层析分离技术的应用实现了蛋白质等生物大分子的规模化分离纯化,促进了高纯度蛋白质药物产品的成功研发。药物制剂方面,采用微球对蛋白、多肽等生物药物进行包埋,能轻松实现对药物活性的保护和释放周期的延长,是目前最常用的药物缓释制剂。
近年来,随着研究的深入和制备技术的提升,同时为满足生物制药持续不断的发展变化的应用需求,微球核心技术也在持续迭代和突破,其在生物制药行业中的赋能潜质逐步提升,推动着生物制药行业的全链条创新。
在生物制药中,微球主要使用在于细胞培养、层析分离、药物递送、疫苗佐剂等领域(图1),以微载体、分离介质等产品形式推动并支撑着生物制药产业的创新及发展。
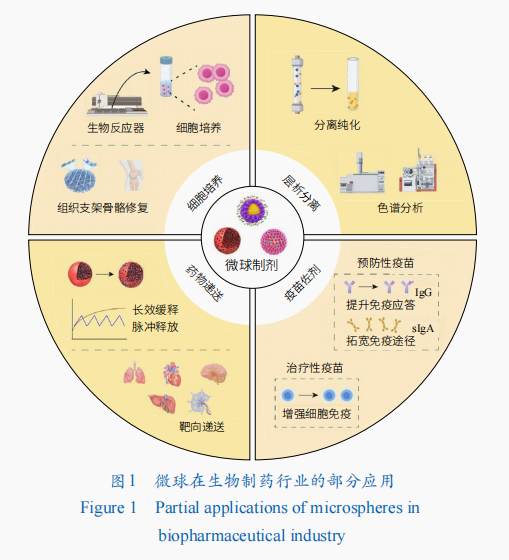
微球作为细胞培养的微载体能够给大家提供比平面载体更大的比表面积,明显提升细胞扩增数量,同时提高反应器和培养基的利用效率。随着再生医学领域的加快速度进行发展,干细胞因其在多种疾病治疗中的潜力而得到科研界和产业界的高度关注。细胞培养是生物制药领域的核心环节,细胞扩增的效率和细胞的活性直接决定应用效果和生产所带来的成本,充足数量、良好活性和功能的干细胞是实现临床应用的必要保证,但干细胞的培养比常规细胞更复杂,对培养环境极为敏感。微载体的多种物理和化学特性,例如机械硬度、孔隙结构、表面功能、粗糙度和微图案化都会影响干细胞的贴附、增殖、分化及因子表达等(表1)。针对不同干细胞体外培养的特定需求,多种“定制化”微载体被开发出来并已成功应用,例如机械硬度可控的微载体、能够特异性结合间充质干细胞(MSCs)的亲和微载体、仿生微环境(Niche)微载体、可降解三维(3D)培养微载体等。以下将从2个方面举例说明。
微载体。机械强度可控的微载体。研究之后发现细胞外环境的硬度变化会刺激影响细胞骨架的力学特性,进而导致细胞骨架的重排和细胞张力的变化,这些变化会促进影响细胞膜上的黏附位点,最后导致细胞形态、黏附和铺展的改变。然而,微载体硬度对于干细胞规模培养具体的影响规律尚未完全阐明,笔者团队在这个方向作出了探索,通过调控微球中基质材料的含量,成功制备了不同硬度的微载体。例如,对于骨髓间充质干细胞(BM-MSCs),微载体的硬度存在最优值,过高或过低的硬度都会影响干细胞的增殖、分化潜能和因子表达。此外,传统工艺需要先将骨髓间充质干细胞从骨髓中提取后再培养,提取过程中多次贴附、洗脱、离心的步骤给细胞带来极大伤害。利用间充质干细胞特异性亲和多肽修饰的微载体,可将提取与培养工艺有机结合,实现特异性的提取与扩增一体化培养,有效促进骨髓间充质干细胞的增殖和干性维持,显示出在大规模干细胞培养中的应用潜力。仿生Niche微载体。针对羊膜上皮干细胞存在的增殖效率低、传代有限、难以维持细胞特性等挑战,通过层层组装技术将细胞外基质(ECM)活性成分引入微载体表面构建的仿生Niche微载体,实现了对细胞周围微环境的组成、结构和硬度等多因素的模仿。仿生Niche微载体可以有明显效果地支持羊膜上皮干细胞的增殖和特性维持,明显提高扩增效率至200倍以上,远高于传统二维培养仅10多倍的扩增倍数,同时保持了细胞的生物学特性。这种显著的提升有望满足临床应用中对羊膜上皮干细胞数量和质量的要求,为其在再生医学和临床治疗领域的应用提供有力支持。
培养设备。除了微载体的优化,培养设备的改进对干细胞培养也至关重要。微载体培养依赖动态运动以使微载体保持悬浮状态,并确保培养体系中氧气、营养的东西和细胞代谢物的均匀分布,这比平面培养中的营养和代谢扩散更高效。动态运动虽然促进了细胞间信号的交流,但同时也会产生剪切应力。鉴于干细胞对机械力和物理力的高度敏感性,动态流体环境和剪切力成为影响细胞生长和质量的主要的因素。因此,如何使生物反应器既能提供柔和、低剪切力的动态环境,又能满足培养环境均匀性的要求,是反应器设计中的一大挑战。针对这一问题,笔者团队设计了多模式可控波动生物反应器,可形成多种运动模式,以适应细胞贴附、增殖、收获等不同阶段的需求。通过多模式运动策略,有效解决了单一运动模式在低剪切力条件下混合效果不佳、导致细胞团聚和活性下降等问题。控制管理系统使用先进的自动化技术,集成了智能温度控制、气体控制和级联蠕动泵,通过优化预置控制算法,实现对温度、溶氧、pH值、换液等关键参数的自动调节和稳定控制。整个培养过程均在全封闭环境下进行,与一次性细胞培养袋配合使用,能够大大降低污染风险,并为细胞提供稳定、安全的生长环境。
微球作为层析分离的介质能够给大家提供良好的机械稳定性、比表面积及分离容量,满足生物活性物质快速高效分离的要求。层析技术是迄今为止应用最广泛和最主要的生物药纯化技术,具有纯化效率高、过程温和、操作简单便捷、自动化程度高等诸多优势。交联琼脂糖微球、葡聚糖微球等分离介质作为层析核心材料,其粒径大小及分布、配基类型及密度、孔结构、间隔臂类型等因素直接影响分离效果乃至生物药的纯度、回收率和活性。多年来,国产分离介质企业从研发到应用,再到创新药生产供应,努力克服进口介质“卡脖子”的不利局面,实现分离介质全面国产化,保障生物药国家安全。相对于进口介质的标准化产品,国产介质通过对粒径、孔径、配基和间隔臂等关键结构特征进行按需设计和精准调控等一系列自主创新,产品更符合实际纯化体系的需求。此外,国产企业在介质的规模化制备能力、批次间稳定性以及规范化产品质量标准等方面都在不断取得突破,突破进口介质在国内分离纯化领域所占据的主导地位是国产分离介质产业化目前最重要的发展目标。以下将举例2种层析介质。
高分辨率介质。由于生物体系组成复杂,目标分子有效含量通常极低,高分辨率的分离介质对于提高目标产物纯度具备极其重大意义。分离介质的粒径均一性提高和粒径减小可大幅度提高分离的分辨率,然而随着介质粒径的降低,其操作压力和反压增大,这必然对介质的机械强度提出更高的要求。例如,琼脂糖属于多糖体系,黏度较高,常规的乳化方法很难制备均一的微球,且琼脂糖微球的强度与其浓度成正相关,但浓度的提高又会带来黏度的增加,造成乳化分散的难度进一步增加。笔者团队通过自主研制多种高温膜乳化设备,成功地在高黏度琼脂糖体系上实现了粒径从数微米至数十微米的调控,获得了粒径小于10微米的高强度均一琼脂糖微球,大幅度提高分辨率和分离速度。高强度、均一小粒径琼脂糖分离介质技术已转让并实施,系列蛋白质纯化介质在全球上市,实现了分离速度3倍提升,分辨率1.5倍提升。
超大孔介质。针对超大生物分子尺寸大、结构较为复杂多变等特点开发的超大孔介质是另一类按需设计介质的典型代表。这一类介质同时具有扩散孔和贯穿孔,生物分子在介质内部通过对流和扩散进行流动,从而明显提高传质效率。通过反胶团溶胀法制备得到平均孔径分别为120纳米和280纳米的超大孔DEAE-PSt离子交换介质,这种超大孔介质对乙肝疫苗病毒样颗粒(HB-VLPs)的分离纯化能力远高于传统琼脂糖介质,不仅载量更高,而且超大孔结构可避开病毒样颗粒(VLPs)的解聚,从而获得更高的活性回收率;通过复乳液模板法制备孔径达到1 000—3 000纳米的超大孔介质,结合快速膜乳化技术,实现了大孔介质孔径和粒径均一可控的制备,这种介质适用于百纳米级生物大分子,如流感病毒、狂犬病毒、噬菌体、外泌体等的高效分离纯化。同时,该介质具有高机械强度和高流速的特点,能够降低生物大分子纯化的成本并提高分离的效率。
匀速缓释微球。微球作为蛋白质、多肽等生物药的递送载体,不但可以保护药物活性,还可通过调控药物的释放位置、释放速率实现降低副作用、增加药效的目的。采用微球包埋药物,随着微球的降解,药物从微球内部被缓慢释放开来,可实现降低给药频率、减小血药浓度波动、延长有效血药浓度维持时间。例如,艾塞那肽注射液每天注射2次,其长效微球制剂只需每周注射1次,给药频率大幅度降低,血药浓度稳定时间大幅延长。对于缓释制剂,微球的粒径大小及分布至关重要,直接决定药物的释放曲线。笔者团队开展了以微球作为药物载体的相关研究(表2),基于膜乳化先进制备技术,成功实现了多种粒径均一微球的制备,并建成国际首条符合药品生产质量管理规范的均一缓释微球的中试线个粒径均一的缓释微球药品的临床批件。
脉冲缓释微球。对某些药物来说,匀速缓释并不是最优的释药曲线,故脉冲释放制剂也非常关注。以促骨细胞生成药甲状旁腺激素类似物特立帕肽为例,当特立帕肽每日血药浓度高于内源甲状旁腺激素浓度的时间不足4小时,药物对骨的影响表现为促骨形成;当每日特立帕肽血药浓度高于内源甲状旁腺激素浓度的时间超过4小时,药物对骨的影响表现为促骨吸收。因此,常规的匀速缓释制剂用于特立帕肽的递送时,难以满足促骨形成的用药需求,必须对微球载体进行合理化设计以实现药物的脉冲释放。笔者团队在利用膜乳化技术实现对微球粒径精准控制的基础上,制备不同粒径大小的均一微球,通过将不同粒径的微球合理复配使用,可以轻松又有效地实现药物的脉冲释放。此外,笔者团队通过对乳化工艺的调控,成功制备了同一粒径、不同壁厚的中空微囊,通过对微囊的内部结构调控,一样能实现药物的可控脉冲释放,获得具有不同脉冲模式的药物载体。
自愈合大孔微球。生物药物的活性易受外界环境影响。采用包埋法负载药物时,所使用的有机溶剂及剪切力易造成药物活性丧失;吸附法虽可以避免制备工艺对药物活性的影响,但其负载率有限,且容易发生突释。研究利用聚乳酸(PLA)较低的玻璃态转化温度,创制了一种自愈合大孔微球,该微球可以分散在药物溶液中,在玻璃态转化温度下微球上的大孔发生闭合,将药物包载在微球内部。这一创新的“后包埋”方法制备条件温和、负载率高,可有效保护药物活性,并且该微球还可与生物活性材料结合用于特殊部位的给药。例如,玻璃体视网膜疾病是临床上一类常见的眼部疾病,现有疗法需要频繁治疗且存在副作用,新兴的细胞疗法受制于体内细胞存活率低、病理环境下细胞表型不稳定、细胞产品保存条件苛刻等一系列难题而难以临床应用。笔者团队将外泌体与自愈合大孔微球结合,能轻松实现在尺寸、内部结构、分泌行为等方面对功能性细胞的模拟,同时可以在玻璃体内持续释放活性外泌体,有利于长期发挥药效。微球在玻璃体腔内注射后,可以向下沉降并滞留于玻璃体腔底部,避免了活细胞注射后悬浮于玻璃体腔而影响视线的问题。通过负载不同细胞来源的外泌体,该体系在治疗视网膜细胞凋亡、眼内炎症等疾病上均表现出良好的效果。
药物靶向递送载体。随着技术的发展,依靠微球降解实现药物缓释这一释药模式已难以满足多样化的药物递送需求和应对体内的复杂环境。结构更为复杂、能轻松实现更为精准多样释药模式的递送载体得到了较大的关注,如具有自主动力、可通过导航和驱动实现动态靶向的递送载体。美国加州理工学院高伟团队开发出一种基于超声驱动的水凝胶微型机器人用于药物递送,该载体具有独特的双开口气泡捕获腔结构,使其能够在多种生物流体中均保持持续和有效的推进能力,并可与超声成像技术结合,实现对载体运动和轨迹更精确的调控及跟踪。另有一项研究构建了pH敏感的微马达递送载体,以实现肠道靶向给药,研究者将具有pH敏感性的Eudragit®聚合物涂层涂覆到Mg-Au微马达上,微马达在到达肠道后基于pH响应性能轻松实现载体的快速运动及药物的完全释放。
疫苗佐剂作为制剂中的重要组成部分,可以发挥增强免疫原性,调节抗体亲和力、特异性和亚型分布,刺激细胞免疫应答,降低抗原剂量,减少接种频率及提高老年、儿童等免疫功能不全者的应答成功率等作用。微球尤其是具有仿生特性的微球制剂是近年来疫苗佐剂的研究热点之一,通过合理设计,微球制剂可模仿天然病原体的尺寸、电荷、形状等物理特性,并可将抗原高密度装载于表面,模仿病原体表面特征蛋白和危险信号分子的排布方式,提升抗原呈递细胞(APC)对其的识别摄取效率。
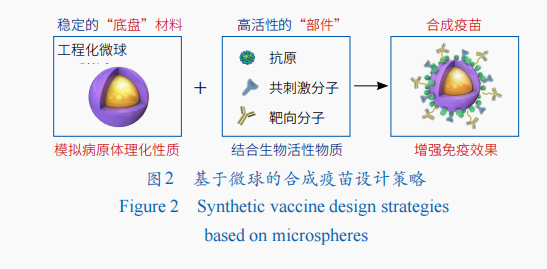
笔者团队提出了以微球作为疫苗“底盘”的合成疫苗工程的新思想,即用结构功能化微球模仿病毒、细菌等病原体,作为合成疫苗的“底盘”,与抗原等部件组装,构建更稳定、高效且能大规模生产的人工合成疫苗(图2)。基于对微球粒径和形貌等性质的精准可控制备,可系统评价微球的粒径、形状、电荷等与细胞的相互作用和对细胞的免疫增强效果。正电荷微球可通过质子海绵效应促进抗原的溶酶体逃逸以提高细胞免疫应答,通过对微球表面电荷的调节,可得到多种溶酶体逃逸型微球佐剂,显著提高细胞免疫应答。除发挥递送抗原的作用外,微球在注射部位的缓慢降解还可形成有利于APC的募集、细胞因子分泌和抗原交叉提呈的局部免疫微环境,实现长效的免疫应答。
将微球与乳液结合,还可以在常规刚性微球的基础上加以突破,得到一类特殊的柔性制剂Pickering乳液。这类制剂由微球稳定的乳液组成,可模仿天然病原体的黏弹特性,在与APC接触时,发生应力学形变将接触区域从点扩大到面,获得较大的免疫识别界面。同时,抗原分布于界面,可在微球缝隙间自由流动,向制剂与细胞接触区域富集,进一步强化免疫识别和细胞摄取。用这种方法构建的禽流感及肿瘤疫苗免疫效果远优于已有疫苗。目前,多种生物相容性微球已被应用于Pickering乳液制备,例如聚乳酸-乙醇酸共聚物(PLGA)、壳聚糖、白蛋白等,通过微球性质的改变进一步提升和拓展了免疫增强性能。例如,采用白蛋白颗粒制备的Pickering乳液,还可通过柔性形变自适应间质细胞20—100纳米的间隙,从而变形穿过细胞缝隙,达到组织渗透的目的,显著提升了淋巴结递送效率和免疫应答效果,为疫苗富集至淋巴结提供了新策略。
在对Pickering乳液研究的过程中,笔者团队还发现微球在乳液上的分布位置直接影响其免疫效果及免疫偏向。当微球分布在乳液外水相中时,微球与乳液的协同作用最弱,免疫增强效果不明显;微球分布在乳液油水界面的Pickering乳液组,具有Th1型免疫偏向,在增强体液免疫的同时,可显著增强细胞免疫应答;微球分布在乳液内水相的复乳组,其具有Th2型免疫偏向,在增强体液免疫应答、实现长效免疫方面的优势更为明显。
在生物制药领域,微球的应用领域仍由国外占据引领地位。例如,细胞培养微载体、分离介质和缓释微球等产品均由国外最早发明并付诸产业化。国外行业早期的布局和多年的积累导致我国在微球的应用方面仍存在不自信的问题,盲目相信进口,相关科研单位和企业每年花大量经费购买微载体、分离介质等。这一现状既不利于摆脱国外垄断,也不利于我国生物制药的行业发展。目前,我国微球技术发展应重视以下2个方面:创新制备技术的应用可以有效提升现有微球的性能。通过对微球性能的提升和应用的拓展,能轻松实现弯道超车,完成对现有微球的替代。例如,3D打印技术可以制备除传统球形外多种复杂形貌、结构的微球,满足不同的应用需求。创新制备技术的发展必须关注放大可能性。众多先进的制备技术已经在实验室研究中应用,但国内的微球工业制备目前仍多采用机械搅拌、均质乳化等传统分散技术,放大效应的存在导致多数制备技术难以放大,放大技术和配套设备是横亘在成果转化之间的最大障碍。
中国科学院过程工程研究所多年来深耕微孔膜乳化技术,建立了国际领先的尺寸均一可控、结构可调的微球精准制造技术,自主研发了高通量膜乳化器,实现了加料、乳液制备、乳滴质控、乳滴聚合及后处理等全过程的计算机控制和数据记录、集成;所制备的液滴均匀性、重复性好;设备能自动控制,操作简便,运行平稳,可以用于多种乳液及微球的制备。尤其是在生物制药行业,该设备可减少人工操作及染菌风险,为微球制剂的临床申报奠定了基础。目前,已有2个均一可降解微球新型药物制剂依托这一设备和技术获得临床批件。
对于生物制药中的微球设计,人工智能同样能发挥巨大潜能。以药物递送中的微球制剂为例,以往制剂的优化需要通过大量的湿实验进行,通过大量的试错循环不断调整配方,逐步达到期望的药物递送效果及释放特性。这是研发过程中最为耗时耗力的阶段。由于配方与结果之间的相关性往往并不明确,规律预测困难,仅能依靠经验进行半定量摸索调试,因此往往会陷入“配方调控→制备→载药量→体外释放”的迭代循环模式。此外,由于体外释放与体内释放之间无明确映射关系,往往在完成上一轮迭代实验之后,又需要继续“体内释放→配方调控”的重复调整。借助人工智能的帮助,综合大量文献及临床数据,提取关键特征,可建立大数据平台和人工智能预测平台,构建贴合实际研发过程的缓释微球系统性数据集,并基于机器学习算法,对药物释放数据来进行大量训练,实现由配方到释放的精准预测,精准调控释药模式,极大提升研发速度并减少研发成本。
微球作为生物制药中的重要核心技术,其质量事关人民健康安全,在实际应用前必须建立健全完备且科学的评价手段及品质衡量准则。我国生物医药起步较晚,在实际应用中微球产品相关的标准较少,且在已有产品的效果评价和标准制定方面多参考国外范例;对于分离介质、药物制剂等原始创新的产品缺少标准参考,限制了国产微球材料的发展。2019年,中国科学院过程工程研究所生化工程国家重点实验室联合中国标准化研究院、中科森辉微球技术(苏州)有限公司,共同制定了我国首批琼脂糖微球分离介质国家标准,为我国分离介质行业的产品研制、生产和应用推广提供了统一、规范的检测的新方法支持和产品质量控制依据,有利于规范行业发展,提升产品质量和市场竞争力。只有重视先进评价手段和规范品质衡量准则的建立,才能够有效有序地引领我国微球材料高质量规范创新发展,为微球在生物制药中的应用保驾护航,推动我们国家向科学技术创新驱动药品研发的范式转型,助力医药工业由中国制造迈向中国创造。
(作者:吴颉、周炜清、赵岚、马光辉,中国科学院过程工程研究所中国科学院大学化学工程学院。《中国科学院院刊》供稿)

